Vaincre les superbactéries, l'un des grands défis de ce siècle

- Désactiver les mécanismes de résistance bactérienne
- Un changement de paradigme dans l'administration des médicaments
- Des antimicrobiens de nouvelle génération pour réduire la virulence bactérienne sans tuer les bactéries
- Un vaccin pour prévenir les infections à Klebsiella pneumoniae
- L'utilisation responsable des antibiotiques est cruciale
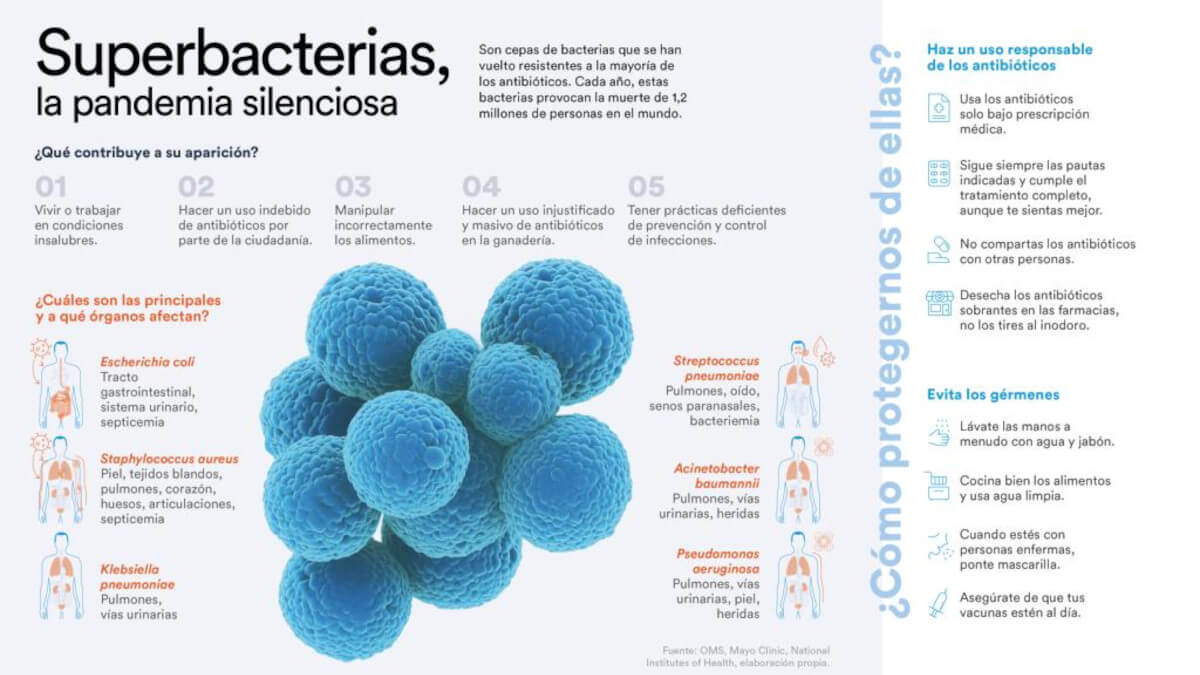
Chaque année, 1,2 million de personnes dans le monde meurent d'infections causées par des bactéries résistantes aux antibiotiques. Selon l'OMS, la capacité des bactéries à s'adapter et à résister aux médicaments conçus pour les combattre constitue déjà l'une des plus grandes menaces pour la santé publique mondiale. Si rien n'est fait, la résistance aux antimicrobiens pourrait entraîner jusqu'à 10 millions de décès dans le monde d'ici à 2050. Quatre projets de recherche financés par les appels CaixaResearch Health Research et CaixaImpulse Health Innovation 2023 cherchent à relever ce grand défi pour l'humanité avec des approches très différentes.
Désactiver les mécanismes de résistance bactérienne
Lorsque Daniel López Serrano, biochimiste au Centre national de biotechnologie du Conseil national de la recherche espagnol, a commencé à faire de la science fondamentale dans un laboratoire au début des années 2000 et a demandé des échantillons aux hôpitaux, il n'a trouvé qu'une seule superbactérie parmi les 20 échantillons qu'il a reçus. Aujourd'hui, il n'est pas rare que les 20 échantillons contiennent des bactéries résistantes aux antibiotiques. C'est pourquoi la découverte d'un nouvel antibiotique efficace est un défi majeur pour l'industrie pharmaceutique. « La recherche peut durer des décennies sans garantie de résultats, et la résistance aux médicaments apparaît de plus en plus rapidement, ce qui décourage les investissements dans la recherche et le développement de nouveaux antimicrobiens », explique López Serrano.
Le projet mené par ce chercheur vise à restaurer l'efficacité des antibiotiques qui ont cessé d'agir en raison de l'augmentation des bactéries résistantes. En 2010, son équipe a découvert un processus cellulaire essentiel à la survie des bactéries lors des infections. Il explique : « Ce mécanisme est responsable de la stabilisation et de l'assemblage de la machinerie protéique des bactéries, y compris la machinerie responsable de la résistance aux antibiotiques. Au fil des ans, nous nous sommes efforcés de comprendre ce mécanisme et nous avons pu concevoir des traitements qui l'inhibent. Nous avons ainsi pu empêcher l'assemblage de tous ces mécanismes. Dans cette situation, l'administration d'antibiotiques classiques fonctionne car les bactéries ont désactivé leurs mécanismes de résistance.
Selon López Serrano, le grand avantage de ce projet, qui a reçu une subvention de 494 300 euros dans le cadre de l'appel à propositions CaixaResearch Health Research 2023, est précisément qu'il propose un traitement capable de guérir des infections qui ne pouvaient pas l'être, et ce en réactivant des antibiotiques disponibles dans le commerce.
« Ce que nous avons découvert n'est pas une molécule, c'est un mécanisme, donc la façon la plus directe de le mettre en œuvre sera probablement de le développer en tant que processus ou thérapie hospitalière, plutôt que de le commercialiser », argumente le chercheur. « Jusqu'à présent, nous avons conçu la procédure pour quelques espèces bactériennes et nous allons essayer d'étendre ces connaissances à d'autres espèces, les plus fréquentes dans les hôpitaux, afin de créer un traitement universel ».
Un changement de paradigme dans l'administration des médicaments
Lorsqu'un nouvel antibiotique est mis au point, il peut arriver que, bien qu'il ait la capacité d'attaquer la bactérie, il ne parvienne pas à traverser la membrane bactérienne. Les stratégies actuelles visant à faciliter cette traversée de la membrane n'ont pas été pleinement efficaces. Le projet dirigé par Javier Montenegro, chimiste au Centro Singular de Investigación en Química Biológica y Materiales Moleculares (CiQUS) de l'université de Saint-Jacques-de-Compostelle, en collaboration avec Mariana Pinho, de l'Universidade Nova de Lisboa, utilise une nouvelle approche pour transporter les antibiotiques dans les bactéries, ce qui pourrait permettre d'utiliser les antibiotiques existants sur des souches résistantes ou peu perméables.
« Il s'agit d'un défi très complexe, car il n'est pas facile de traverser la membrane des bactéries, en particulier les bactéries gram-négatives, dont la membrane externe constitue une barrière supplémentaire », explique Montenegro. Dans de nombreux cas, les approches actuelles « utilisent des lipides pour traverser des membranes formées par d'autres lipides », ce qui nécessite « l'encapsulation des molécules, ce qui peut affecter à la fois leur stabilité et la libération de l'antibiotique au bon moment », ajoute-t-il.
Cependant, l'équipe de Montenegro et Pinho a découvert une propriété des amas de bore qui permet aux molécules hydrophiles - molécules qui se dissolvent dans l'eau - de traverser les membranes lipidiques. Pour M. Montenegro, cette étape scientifique majeure, qui a reçu 984 050 euros de l'appel à propositions CaixaResearch Health Research 2023, représente « un changement de paradigme complet pour la science et l'administration de médicaments. Il s'agit d'une recherche très novatrice et complètement différente du dogme établi. Nous devons maintenant comprendre la base de ce mécanisme afin de l'appliquer au transport des antibiotiques.

Des antimicrobiens de nouvelle génération pour réduire la virulence bactérienne sans tuer les bactéries
Si les antibiotiques peuvent tuer les micro-organismes, ils contribuent paradoxalement à l'émergence de bactéries résistantes et facilitent leur prolifération dans un environnement dépourvu de concurrents. Par ailleurs, le développement des antibiotiques est actuellement au point mort.
C'est pourquoi certains projets de recherche se concentrent sur le développement de stratégies thérapeutiques alternatives pour désactiver la virulence des superbactéries et les resensibiliser aux antibiotiques, tout en préservant le microbiote, la communauté bactérienne naturelle de notre organisme, qui peut être perturbée par les traitements antibiotiques de routine. Cet écosystème délicat joue un rôle essentiel dans notre santé intestinale, dermatologique et mentale, ainsi que dans notre système immunitaire, nos défenses contre les pathogènes, notre métabolisme et la régulation de notre poids corporel.
L'équipe de Didier Cabanes, biologiste moléculaire à l'Instituto de Investigação e Inovação em Saúde de l'Universidade do Porto, étudie les bactéries gram-positives, telles que les staphylocoques, les streptocoques et les Listeria. Dans la paroi cellulaire de Listeria, il a découvert que « certains glycopolymères (sucres) présents à sa surface - qui n'étaient pas déterminants pour sa croissance - étaient cruciaux non seulement pour la résistance de la bactérie aux défenses antimicrobiennes de l'hôte et aux antibiotiques, mais aussi pour la pathogénicité de la bactérie ». C'est pourquoi les chercheurs estiment que « les enzymes responsables de la présence de ces glycopolymères à la surface de la bactérie sont des cibles prometteuses pour les médicaments antimicrobiens contre les pathogènes à Gram positif ».
Le projet, en collaboration avec la Fundação para a Ciência e a Tecnologia (FCT), a reçu une subvention de 499 950 euros dans le cadre de l'appel à propositions CaixaResearch Health Research 2023. Son objectif ultime est de développer des médicaments antimicrobiens de « nouvelle génération » qui, en inhibant les glycopolymères présents à la surface des superbactéries, réduisent leur virulence sans les tuer. De cette manière, ils deviendront progressivement sensibles aux défenses de l'hôte et l'action des antibiotiques sera renforcée tout en préservant le microbiote. « Notre approche est la première à désarmer et à sensibiliser simultanément les pathogènes gram-positifs sans affecter leur croissance », conclut M. Cabanes.

Un vaccin pour prévenir les infections à Klebsiella pneumoniae
Dans le dernier rapport du Centre européen de prévention et de contrôle des maladies, Klebsiella pneumoniae figure parmi les trois principales causes d'infections résistantes aux antibiotiques. Plus précisément, plus de 45 000 cas d'infection par cette bactérie ont été détectés en Europe en 2022, dont plus de 15 % causés par des souches immunisées contre l'effet de ces médicaments. C'est pourquoi l'OMS a classé Klebsiella pneumoniae parmi les espèces de préoccupation critique dans le domaine de la santé et que l'équipe dirigée par Mireia López Siles, microbiologiste à l'université de Gérone, a décidé de développer un vaccin pour poursuivre la lutte contre cette bactérie.
Klebsiella pneumoniae est une bactérie que l'on peut trouver dans n'importe quel environnement. En milieu hospitalier, elle se transmet généralement par contact avec la peau, les muqueuses, les matières fécales, les plaies ou l'urine d'une personne infectée. La situation s'aggrave lorsque la souche à l'origine de l'infection est également résistante aux antibiotiques. Un vaccin pourrait augmenter la durée de la protection contre la bactérie par rapport à un traitement antibiotique, fournir une immunité collective et réduire la mortalité associée à ces infections. « Il s'agit d'un élément clé, car il réduirait l'utilisation d'antibiotiques pour traiter les infections et la probabilité d'apparition d'autres bactéries résistantes aux antibiotiques », explique López Siles.
Le projet, qui a reçu 50 000 euros de l'appel CaixaImpulse pour l'innovation en santé (financement complété par le soutien d'experts et de mentors), est en phase préclinique. L'objectif de cette phase est d'évaluer la capacité de protection in vivo de KlebsiGene, un vaccin à ADN développé précédemment par l'Université de Gérone et l'Institut de santé Carlos III, et d'améliorer sa formulation. D'une part, le vaccin cible des parties de la bactérie qui n'ont pas été utilisées auparavant dans d'autres vaccins et qui jouent un rôle clé dans la survie de la bactérie, de sorte que nous nous attendons à ce qu'il confère une meilleure protection. En outre, nous utilisons une nouvelle technologie d'ADN qui incorpore des éléments permettant de stimuler la réponse immunitaire du patient.
Jusqu'à présent, l'équipe dirigée par López Siles a mis au point huit prototypes de vaccins et a constaté que les cellules humaines interprétaient correctement les informations fournies par ces vaccins. « Nous avons également constaté, grâce à la prédiction à l'aide d'outils bioinformatiques, que tous les candidats vaccins ne fonctionnent pas de la même manière pour générer une réponse immunitaire. Cela nous a permis de donner la priorité aux prototypes les plus prometteurs pour les tests d'efficacité. Nous avons maintenant achevé la phase de production de deux d'entre eux. La prochaine étape consiste à démontrer dans un organisme complexe que notre vaccin est capable d'activer le système immunitaire et de protéger contre l'infection".
La mise au point de ce vaccin « améliorera la qualité de vie des personnes exposées au risque d'infection par ce micro-organisme, en particulier en milieu hospitalier », ajoute-t-elle. De plus, comme il s'agit d'un vaccin à ADN, il est facilement adaptable à d'autres pathogènes, « car il contient un fragment d'ADN spécifique qui code pour l'antigène (la partie qui permettra à la réponse immunitaire de se développer), qui dans notre cas est spécifique à Klebsiella pneumoniae. En échangeant ce fragment contre un fragment codant pour un antigène de n'importe quel autre micro-organisme, on obtiendrait un vaccin ciblant cette autre espèce. Il pourrait également être conçu pour prévenir l'infection par plusieurs pathogènes simultanément, si des séquences d'antigènes pour les deux espèces sont incluses".
L'utilisation responsable des antibiotiques est cruciale
Cette augmentation généralisée des superbactéries « est en partie naturelle - les bactéries évoluent et acquièrent une résistance », explique López Serrano, « mais avec notre utilisation des antibiotiques, nous avons également contribué à créer des environnements, tels que les hôpitaux ou les élevages (où les antibiotiques ont été largement utilisés non seulement pour traiter les infections bactériennes chez les animaux, mais aussi pour favoriser leur croissance, ainsi que pour prévenir les maladies sans diagnostic préalable), qui facilitent ce processus d'évolution », rendant ainsi les antibiotiques de plus en plus rapidement inefficaces.
Depuis un certain temps, les autorités sanitaires travaillent sur des stratégies visant à rationaliser l'utilisation des médicaments antibiotiques, notamment en sensibilisant le public. Comme le rappelle Didier Cabanes, ils ne doivent être utilisés « que sur prescription médicale et en cas de réelle nécessité ». De plus, « les traitements doivent être terminés », ajoute López Serrano, « et il ne faut pas les stocker pour les prendre quand on veut ou les donner à ses voisins. Un autre point important est l'élimination des antibiotiques : si nous jetons les restes d'antibiotiques dans les toilettes, ils se retrouvent dans l'environnement et les bactéries s'y trouvent également ». L'avenir des superbactéries est également entre nos mains.